
Vi ska se hur runda atomer kan förklara en hel del kristallstrukturer. I de allra flesta fasta ämnen sitter atomerna på rad. Raderna är tusentals atomer långa i mikrokristallina material som stål, eller miljontals atomer långa i koksalt. Ämnet består utav en upprepning av exakt samma cell, på samma sätt som en machinellt tillverkad tapet, men då i tre dimensioner. Det gäller inte bara kristallsocker och koksalt, men även nästan alla metaller och vanliga stenar, där man med blotta ögat inte ser kristallfasetter.
Undantag är plast och glas. Även kristallglas har en oordnad struktur som liknar en vätska, utan något mönster som uppepar sig. (Fasetterna i såkallad kristallglas är slipade.). Även trä är förstås ingen kristall och ett fast ämne som denna kurs inte ska beröra.
Om en kristall tillkommer genom att det först bildas ett skikt på en slät yta, blir det samma tätpackade mönster som cellerna i en honungskaka. Varje atom har kontakt med sex närmaste grannar i det två-dimensionella skiktet:

På föreläsningen visar jag det med små metallkulor i en tom CD-fodral på overheadprojektorn. Om fler atomer tillkommer, formas det ett likadant skikt ovanpå. Det görs på samma sätt som när man staplar apelsiner: man lägger dem inte rakt på de andra apelsinerna, men över de hål i det första skiktet:
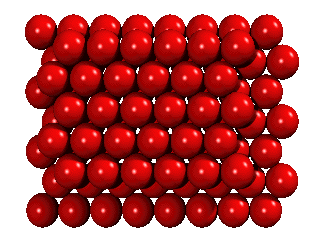
Men om ett tredje skikt tillkommer, har man ett val. Det finns nämligen två sorters hål i det andra skiktet: hälften av de hål ligger ovanpå en atom i det första skiktet, hälften ligger ovanpå att hål. Om man väljer det första, och staplar vidare på samma sätt, får man en stapling ABABA... Om man väljer den andra möjligheten, får man en stapling ABCABCA... Båda strukturer är tätpackade (close packed), och i båda strukturer har en atom tolv närmaste grannar.
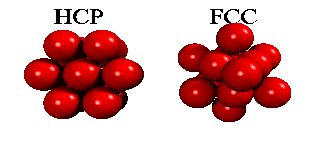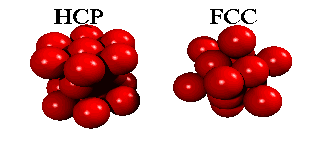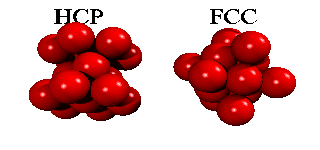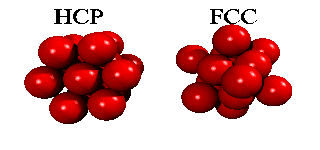
Eftersom en atoms elektroner är utspridda över längre avstånd än till närmaste granne, finns det små energiskillnader mellan båda strukturer. Helium kondenserar under tryck i staplingen ABABA... Den har inte oväntat sexkantig symmetri, och kallas för hcp (hexagonal close packed). De andra edelgaser neon, argon, krypton och xenon, kristalliserar i staplingen ABCABCA... Den har kubisk symmetri, och kallas för ccp (cubic close packed) eller (mycket vanligare) för fcc (face-centered cubic). Här kan man se hur fcc-gittret är uppbygt utav fyra eneklet kubiska gitter.
| Kristall | c/a | Kristall | c/a | ||
|---|---|---|---|---|---|
| He | 1.633 | Zn | 1.861 | ||
| Be | 1.581 | Cd | 1.886 | ||
| Mg | 1.623 | Co | 1.622 | ||
| Ti | 1.586 | Y | 1.570 |
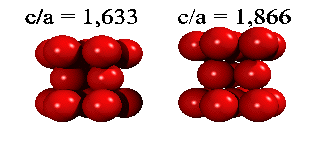
Kristallstrukturen fcc är mycket vanlig, inte bara bland edelgaser men också bland metaller: koppar, silver och guld, nickel, kalcium, aluminium och bly är några exempel.
Eftersom tätpackade ytor brukar ha lägst energi (ytspänning),
har fcc kristaller ofta formen av en oktaeder.
