Diamant, kisel
Kol-atomer beter sig inte alls som runda kulor. De beter sig på samma sätt
som i kemin, med kovalente bindningar i vissa riktningar. Samma sak gäller
för kisel och germanium, också i det periodiska systemets grupp IV.
Också många föreningar mellan grupp III och grupp V (GaAs, InP) och även
II-VI föreningar som ZnS (zinkblände) har samma struktur: varje atom har bindningar till fyra
närmaste grannar som formar en tetraeder. Strukturen innehåller alltså mycket tomrum.
Det är svårt att föreställa sig strukturen. En bra
modell skriven som en Java applet, som man kan vrida med musen, finns på NSDL.
Det kan hjälpa att rita in tetraedrarna, som i följand bild.
Om du klickar följande figur, laddas en animation som gör att den snurrar
runt (207 k).

Ett annat sätt att tolka diamanstrukturen är som kopplade sex-ringar. De ser ut
som cyklohexan i stol-formen,
kopplade tillvarandra för att forma ett plan. De
staplas sedan i ABCABCA... följd. På samma sätt som i fcc strukturen
upptäcker man då att strukturen har blivit kubisk med många {111} plan av
stol-formiga sex-ringar.
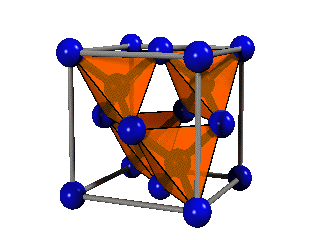

Pister har gjort ett
urklippsark av en kiselkristall där man kan se kislets olika ytor.
Grafit, C60, nanotuber
På samma sätt som i kemin, kan kol i sp2-hybridisering ha tre
kovalenta bindningar i ett plan. Ett exempel är benzen. Om man kopplar
många benzenringar tillsammans, ser det ut som hönsnät. Om man
sedan staplar många sådana skikt på varandra i ABABA-stapling, får man
grafit. Färg, ledningsförmåga, mekaniska egenskaper är totalt annorlunda
än i diamant.
Om man inte staplar, men rullar upp hönsnätet, får man nanotuber.
Om man ersätter några 6-ringar med 5-ringar, får man buckyballs:
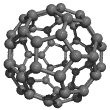
De beter sig som kulor, och kristalliserar i en tätpackad fcc struktur.
Upp till kurssidan


